Chladicí směs vody, ledu a soli
Pokus číslo: 1614
Cíl pokusu
Cílem tohoto pokusu je ověřit, že přidáním kuchyňské soli lze snížit teplotu tání, resp. tuhnutí směsi vody a ledu.
Teorie
Teploty tání, resp. tuhnutí krystalických látek jsou obecně závislé na okolním tlaku a na chemické čistotě látky – možné příměsi mohou teploty tání/tuhnutí významně ovlivňovat. Zatímco rovnovážnému stavu, při kterém může voda koexistovat s ledem, přísluší za normálního atmosférického tlaku teplota 0 °C, při smíchání s kuchyňskou solí (NaCl) se tato teplota sníží.
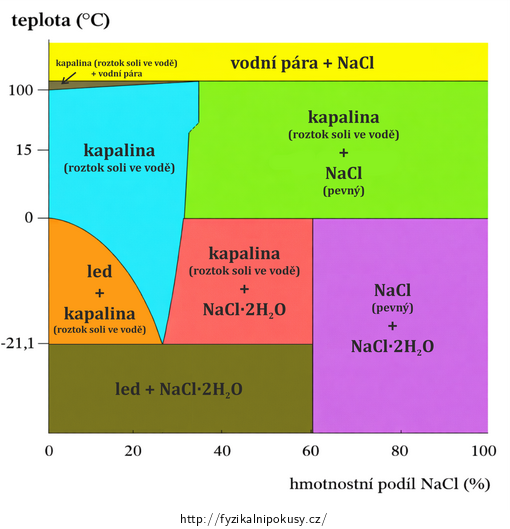
Jak je tento vliv pro různé koncentrace výrazný napoví obr. 1, který ukazuje fázový diagram směsi voda + kuchyňská sůl; svislá osa znázorňuje teplotu, vodorovná hmotnostní podíl soli. Pro každou dvojici teplota-koncentrace tak můžeme nalézt stav, ve kterém se směs právě nachází.
Příklad: Pro padesátiprocentní obsah soli při teplotě 15 °C ukazuje graf do zeleně vyznačené fáze „kapalina+NaCl“, což znamená, že získáme nasycený vodný roztok soli a část soli ještě zůstane nerozpuštěna, v pevném skupenství.
Z grafu je patrné, že nejnižší teplota, při které může směs vody, ledu a soli existovat, je cca −21 °C (přesně: −21,1 °C), a to při hmotnostním podílu kuchyňské soli přibližně 23 % (přsně: 23,3 %).
Pokud tedy k ledu či ledové tříšti přidáváme sůl, snižuje se teplota tání/tuhnutí této směsi a led tak začíná rychle tát. Aby mohla tato fázová přeměna proběhnout, odebírá led ze svého okolí skupenské teplo tání, což způsobuje značný pokles měřené teploty.
Podrobněji je experiment rozebrán na Fyzwebu v příspěvku Mgr. P. Böhma, ze kterého byl převzat a přeložen obr. 1.
Pomůcky
Led, kladívko, kádinka, polystyrenová podložka, voda, kuchyňská sůl, teploměr (obr. 2).

Postup
Několik ledových kostek rozbijeme kladívkem na tříšť a tu přisypeme do kádinky k malému množství vody. Kádinku tepelně odizolujeme polystyrenovou podložkou.
Jakmile se teplota směsi ustálí přibližně na 0 °C, začneme za stálého míchání přisypávat kuchyňskou sůl; teplotním čidlem odečítáme aktuální teplotu směsi.
Vzorový výsledek
Ve vzorovém experimentu se snadno, bez odměřování poměru mezi vodou, ledem a solí, podařilo dosáhnout teploty −15°C.
Technické poznámky
Při výrobě ledové tříště je vhodné kostky zabalit do ručníku či hadru a v něm je teprve rozbíjet (obr. 3). Tento způsob zabraňuje odletování tajících kousků ledu po místnosti.
Výhodou je použití teploměru schopného vykreslovat časovou závislost teploty.
Teploměr s pevným tělem také dobře poslouží při míchání.
K provádění experimentu obvykle není třeba ani zmiňovaná tepelná izolace; jev je i bez ní snadno měřitelný a přesvědčivý.
Na kádince během experimentu namrzá vzdušná vlhkost; kromě toho může kádinka snadno přimrznout k podložce.
Pro výrobu chladicí směsi není nutné používat právě kuchyňskou sůl. Stejný efekt mají také ostatní ve vodě rozpustné soli (např. CaCl2, FeCl2, MgCl2 apod.). Poměry vhodné pro dosažení co nejnižších teplot jsou pro různé soli shrnuty například na české Wikipedii.

Metodické poznámky
Praktickým využitím předvedeného experimentu je kromě přípravy chladicích směsí zejména využití při zimním solení namrzlých chodníků. Žáci obvykle tuto informaci „odkývají“, zkušenost ale ukázala, že jim velmi často vůbec není jasné, jak spolu experiment a praxe souvisí. (Sugestivní otázka ze strany učitele může znít: „Chci, aby led na chodníku roztával, jak mi tedy pomůže, že snížím jeho teplotu?“) Proto je nutné zdůrazňovat, že přidání soli především snižuje teplotu tání/tuhnutí směsi – tedy že můžeme vodu udržovat kapalnou i při teplotách hluboko pod 0 °C. Jinak řečeno, ze zledovatělého chodníku jsme schopni „udělat“ pouze chodník mokrý.
Pozorní studenti mohou přijít s výtkou, že intenzivní míchání směsi může být kontraproduktivní, protože mechanickou prací se zvyšuje vnitřní energie směsi a ta se tedy zahřívá. Tento argument je samozřejmě správný a je rozumné jej ocenit, na druhou stranu je vhodné zdůraznit, že přírůstek teploty při míchání je v tomto případě skutečně zanedbatelný.
Doplňující experiment
Jako doplněk experimentu lze ukázat, že i samotné rozpouštění soli ve vodě způsobuje pokles teploty této směsi. Zde je ovšem fyzikální důvod jiný než ve výše uvedeném pokusu – rozpouštění soli je endotermický děj, kdy směs odnímá svému okolí teplo potřebné na rozrušení krystalické mříže chloridu sodného (můžeme hovořit o tzv. rozpouštěcím teple), nejde zde o skupenskou přeměnu.
Do sklenky s vodou o pokojové teplotě postupně přisypáváme kuchyňskou sůl (také o pokojové teplotě), mícháme a sledujeme, že teplota směsi klesá – pokles ale není nijak výrazný. Video níže odkazuje na provedení tohoto experimentu se systémem Vernier.
Rozšiřující video
Detailnější pochopení fázového diagramu vody a chloridu sodného nabízí následující video z YouTube kanálu YouThermo: