Teplota tání pentahydrátu thiosíranu sodného
Pokus číslo: 1615
Cíl pokusu
Cílem tohoto pokusu je proměřit vývoj teploty při zahřívání pentahydrátu thiosíranu sodného a odhadnout z něj teplotu tání této látky.
Teorie
Teplota, při které pevná krystalická látka mění své skupenství na kapalné, se nazývá teplotou tání tt. Jde o jednu ze základních fyzikálních charakteristik krystalických látek – látky amorfní přecházejí při zahřívání do kapalného skupenství postupným poklesem své viskozity.
Jestliže je pevná krystalická látka zahřívána, přestane se po dosažení teploty tání její teplota dále zvyšovat a veškeré dodávané teplo je využíváno na rozrušení struktury krystalické mříže. Teprve když se látka v celém svém objemu změní na kapalinu, začne se vlivem dodávaného tepla její teplota dále zvyšovat. Takovýto průběh teploty naznačuje graf na obr. 1.
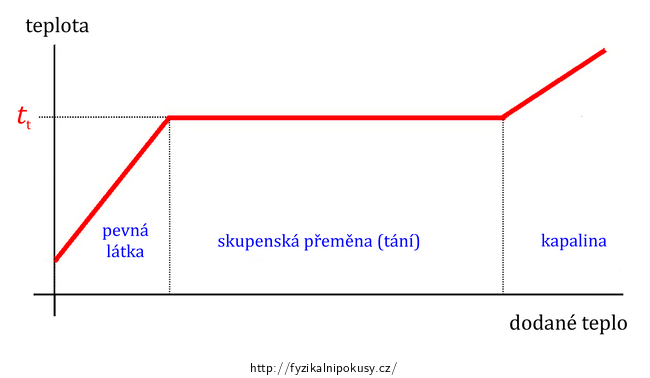
Teplota tání obecně záleží také na tlaku, dále ji pak ovlivňují příměsi – například kuchyňská sůl přidaná do směsi voda-led jí začne odnímat teplo potřebné na své rozpouštění a výrazně tak teplotu tání ledu sníží (viz pokus Chladicí směs vody, ledu a soli).
Pomůcky
Pentahydrát thiosíranu sodného, skleněná nádobka nebo zkumavka, laboratorní stojan s držáky, teplotní čidlo spolupracující s počítačem (ve vzorovém experimentu bylo použito čidlo Vernier Go!Temp), kahan nebo svíčka, zápalky.
Pentahydrát thiosíranu sodného je bílá krystalická látka, jejíž teplota tání (mezi 48 °C a 49 °C) je zcela ideální pro provádění tohoto experimentu. K látce se nevztahují žádné H-věty ani P-věty.
Postup
Do skleněné nádobky (zkumavky) odsypeme přibližně 20 gramů pentahydrátu thiosíranu sodného.
Nádobku umístíme do držáku laboratorního stojanu tak, aby bylo její dno vzdáleno od hořáku kahanu cca 15 – 20 cm.
Teplotní čidlo připojíme k počítači a umístíme ho do nádobky tak, aby jeho měřící prvek (špička) zůstal i po roztátí pentahydrátu ponořený, ale nedotýkal se stěn ani dna nádobky. Výše popsané uspořádání ukazuje obr. 2.
Spustíme program pro záznam dat z teplotního čidla a nastavíme dobu měření na alespoň 25 minut.
Spustíme měření, současně zapálíme kahan a necháme ho hořet velmi malým plamenem.
Měření ukončíme, jakmile teplota roztaveného pentahydrátu překročí 60 °C.

Vzorový výsledek
Po provedení měření obdržíme následující graf závislosti teploty pentahydrátu na čase (obr. 3).
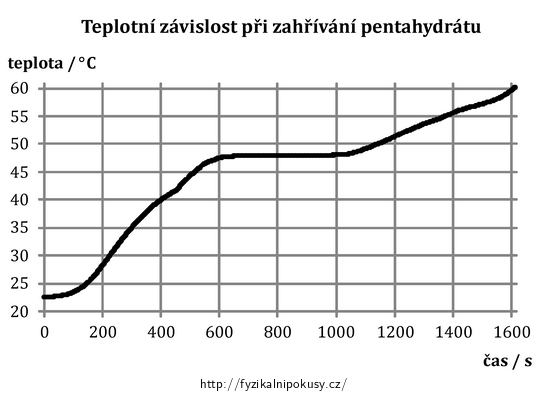
Je patrné, že v první části měření dochází k přibližně lineárnímu nárůstu teploty, následuje její ustálení a v závěru měření opět růst. Z hlediska cíle tohoto experimentu je pro nás zajímavá prostřední část grafu, kdy je teplota pentahydrátu navzdory pokračujícímu dodávání tepla neměnná – v této fázi dochází k tání látky. Teplotu tání tt odtud můžeme z y-ové osy odhadnout jako přibližně 48 °C.
Technické poznámky
Během zahřívání neměňte intenzitu plamene.
Pokud chceme měření urychlit, je samozřejmě možné zahřívat pentahydrát intenzivněji, event. umístit nádobku blíže plamenu. Hrozí ale riziko, že jev ustálení teploty při tání nebude tak výrazný, resp. bude pozorovatelný po kratší dobu.
Budete-li zahřívat nádobku kahanem či propanbutanovým hořákem, zkontrolujte si před měřením, že tento váš zdroj tepla má dostatečné množství náplně, aby vydržel hořet alespoň 25 minut.
Po skončení měření zůstává v nádobce roztavený thiosíran, který lze zlikvidovat jednoduchým vylitím přímo do odpadu.
Metodické poznámky
Pokud budeme ty části grafu, ve kterých teplota roste, považovat za lineární závislosti, lze si povšimnout toho, že předpisy těchto závislostí mají jinou směrnici – v případě kapalného pentahydrátu probíhá zahřívání pomaleji než v případě pentahydrátu pevného, tj. růst teploty je pozvolnější. Protože nádobku zahříváme stále stejným tepelným výkonem, lze na základě výše uvedeného usoudit, že měrná tepelná kapacita kapalného pentahydrátu je vyšší než v případě jeho pevného skupenství (podobně je tomu koneckonců např. u vody a ledu).
Experiment typicky zabere poměrně velkou část vyučovací hodiny (např. polovinu), nicméně v jeho průběhu se můžeme věnovat jiným činnostem – výkladu, zkoušení apod.; není třeba na jeho průběh neustále dohlížet.
Bezprostředně po skončení měření se nedotýkejte zahřívané nádobky ani jejího držáku, hrozí nebezpečí popálení!
Pentahydrát thiosíranu sodného lze dále využít například při experimentu Podchlazená kapalina.








