Experimentální určení měrné tepelné kapacity vody
Pokus číslo: 1619
Cíl pokusu
Cílem tohoto měření je experimentální určení měrné tepelné kapacity vody a její následné porovnání s tabulkovou hodnotou.
Teorie
Základní informace o měrné tepelné kapacitě jsou uvedeny v části Porovnání měrné tepelné kapacity oleje a vody, Teorie. Připomeňme pouze, že známe-li měrnou tepelnou kapacitu c látky o hmotnosti m, která se ohřála (ochladila) o Δt, můžeme teplo Q dodané (odebrané) látce vyjádřit jako:
\[Q\,=\,cm\Delta t.\tag{1}\]V tomto experimentu budeme vodu zahřívat průchodem elektrického proudu topnou spirálou. Jestliže takovou spirálu připojíme ke zdroji napětí U a necháme jí po dobu τ procházet elektrický proud I, vykoná se ve spirále eletrická práce We, pro kterou platí:
\[W_\mathrm{e}\,=\,UI\tau.\tag{2}\]Pokud zahříváme střídavým proudem, jsou U a I jeho efektivní hodnoty.
Při průchodu proudu se topná spirála zahřívá a předává teplo vodě a vnitřní nádobě kalorimetru (vnější nádoba je od vnitřní izolována polystyrenovou vložkou, její ohřev tedy nemusíme uvažovat). Protože platí zákon zachování energie, musí být elektrická práce vykonaná na spirále We rovna celkovému dodanému teplu, matematicky zapsáno:
\[ W_\mathrm{e}\,=\,Q_\mathrm{v} + Q_\mathrm{k},\tag{3}\]kde Qv je teplo dodané vodě a Qk teplo dodané kalorimetru. Na základě vztahu (1) nyní můžeme tepla ve vztahu (3) rozepsat a získáváme:
\[ W_\mathrm{e}\,=\,c_\mathrm{v}m_\mathrm{v}\Delta t\,+\,c_\mathrm{k}m_\mathrm{k}\Delta t,\tag{4}\]kde cv a ck jsou měrné tepelné kapacity vody, resp. materiálu, z něhož je vyrobena vnitřní nádoba kalorimetru, a mv a mk hmotnost vody, resp. vnitřní nádoby kalorimetru. Zvýšení teploty Δt je stejné pro vodu i kalorimetr, protože pokud není zahřívání extrémné rychlé, jsou tyto objekty v tepelné rovnováze.
Závěrem už zbývá dosadit do rovnosti (4) ze vztahu (2) a vyjádřit hledanou měrnou tepelnou kapacitu vody:
\[c_\mathrm{v}\,=\,\frac{W_\mathrm{e}\,-\,c_\mathrm{k}m_\mathrm{k}\Delta t}{m_\mathrm{v}\Delta t}\,=\,\frac{UI\tau\,-\,c_\mathrm{k}m_\mathrm{k}\Delta t}{m_\mathrm{v}\Delta t}.\tag{5}\]Vztah (5) nám tak jasně dává informaci o tom, které veličiny je při výpočtu měrné tepelné kapacity třeba určit.
Pomůcky
Kalorimetr s topnou spirálou (obr. 1), ampérmetr a voltmetr (stejně mohou posloužit dva multimetry), teploměr (s výhodou podporovaný počítačem), zdroj střídavého napětí, váhy.

Postup
Odvážíme si 100 g vody (hmotnost mv). Dále zvážíme vnitřní hliníkovou nádobu kalorimetru (hmotnost mk) a nalijeme do ní uvedených 100 g (tj. cca 100 ml) vody.
Zapojíme topnou spirálu kalorimetru do obvodu se zdrojem střídavého napětí, ampérmetrem a voltmetrem (schéma elektrického obvodu ukazuje obr. 2, fyzické uspořádání experimentu obr. 3).
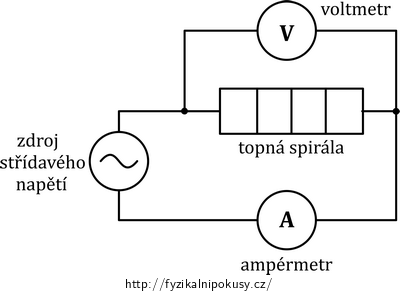
Zvolíme (stále při vypnutém zdroji!) takovou kombinaci napětí zdroje a odporu spirály, aby obvodem při měření protékal proud přibližně 2 A (ve vzorovém měření například 24 V a 12 Ω).
Ještě než zapneme zdroj, změříme počáteční teplotu vody v kalorimetru; teploměr v něm necháme umístěný po celou dobu měření.
Zapneme zdroj a současně začneme měřit dobu průchodu proudu obvodem. Poznamenáme si také hodnotu napětí a proudu v obvodu.
Po zhruba 3 až 4 minutách zdroj vypneme, vodu rychle promícháme vestavěným míchadlem a odečteme její koncovou teplotu. Nezapomeneme si poznamenat čas τ ohřevu.

Vzorový výsledek
Následující tabulka shrnuje sedm vzorových měření provedených pro různé kombinace doby ohřevu τ, hmotnosti vody mv a teplotního rozdílu Δt. Zbylé veličiny byly ve všech měřeních neměnné, a to:
\(c_\mathrm{k}\,=\,896\,\mathrm{J{\cdot}kg^{-1}{\cdot}K^{-1}}\)
\(m_\mathrm{k}\,=\,0{,}031\,\mathrm{kg}\)
\(U\,=\,25{,}9\,\mathrm{V}\)
\(I\,=\,1{,}85\,\mathrm{A}\)
Měrná tepelná kapacita byla dopočítávána podle vztahu (5).
č.měř. mv (kg) τ (s) Δt (°C) cv (\(\mathrm{J{\cdot}kg^{-1}{\cdot}K^{-1}}\)) 1 0,110 180 17,0 4360 2 0,103 200 19,8 4440 3 0,110 200 18,8 4380 4 0,108 190 18,5 4310 5 0,104 210 20,6 4430 6 0,095 195 20,4 4530 7 0,111 185 17,0 4440 Průměrná zjištěná hodnota měrné tepelné kapacity vody činí \(c\,=\,(4410\,\pm\,70)\,\mathrm{J{\cdot}kg^{-1}{\cdot}K^{-1}}\), tabulková hodnota při teplotě 25 °C přitom činí přibližně \(4180\,\mathrm{J{\cdot}kg^{-1}{\cdot}K^{-1}}\); odchylka měření představuje asi 5 % této hodnoty.
Technické poznámky
Před zaznamenáním koncové teploty je skutečně nezbytné vodu v kalorimetru promíchat; v opačném případě můžeme získat velmi zkreslené výsledky. Na základě zkušeností autora pokusu je vhodné míchat po celou poslední minutu měření.
Použití teploměru, který je možné připojit k počítači, může vést ke značnému zpřesnění výsledků zejména tehdy, je-li doba ohřevu krátká a nárůst teploty v důsledku toho malý.
Metodické poznámky
Rovnost (3) představuje jakýsi ideální případ, který neuvažuje například ohřev okolního vzduchu, ohřev polystyrenové izolace kalorimetru, kondenzaci části vody na spodní straně krytu kalorimetru a další tepelné ztráty. V praxi se z ní se tedy stává nerovnost ve tvaru:
\[W_\mathrm{e}\,\gt\,Q_\mathrm{v}\,+\,Q_\mathrm{k}\]Jinými slovy, účinnost přeměny elektrické energie na tepelnou není stoprocentní. Z tohoto důvodu vychází ve výpočtech hodnoty měrné tepelné kapacity systematicky větší, než je tabulková hodnota \(4180\,\mathrm{J{\cdot}kg^{-1}{\cdot}K^{-1}}\).
Fyzikálně zdatnější studenti mohou namítat, že při intenzivním míchání vody v kalorimetru konáme mechanickou práci, což může vést k zahřívání vody uvnitř. Tato myšlenka je principiálně správná a zaslouží ocenění, přestože vliv takovéhoto zahřívání na výsledek měření je prakticky nulový. Chceme-li o tom studenty přesvědčit, můžeme je nechat odhadnout jejich mechanický výkon při míchání a porovnat ho s elektrickým výkonem topné spirály.
Odkaz na související úlohu
Výpočetní úloha, která pracuje s kalorimetrickou rovnicí, je Ohřev vody ve varné konvici.








