Kritický stav oxidu uhličitého
Pokus číslo: 1689
Cíl pokusu
Cílem experimentu je demonstrovat přechod kapalného oxidu uhličitého a jeho syté páry při zahřívání do superkritického stavu a při ochlazování zpět do stavu podkritického.
Upozornění
Není pravděpodobné, že byste tento experiment realizovali ve výuce „naživo“. Jeho provedení je vázáno na unikátní pomůcku, jež je v současné době majetkem MFF UK v Praze; o výskytu dalších exemplářů v ČR nemáme zprávy. Chceme ale umožnit seznámení žáků s kritickým stavem alespoň formou přiloženého videa.
Teorie: Fázové diagramy
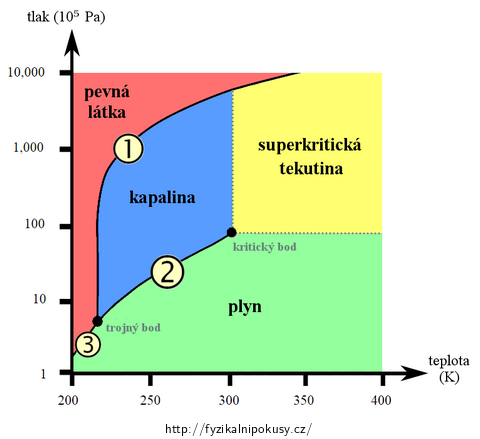
Téměř každá chemicky čistá látka se může vyskytovat v pevném, kapalném nebo plynném skupenství; o tom, jaké z nich zaujme, rozhoduje při stálé hmotnosti její teplota a tlak. Vymezení skupenství těmito dvěma veličinami se obvykle vizualizuje v tzv. fázovém diagramu – příklad takového diagramu pro oxid uhličitý je uveden na obr. 1. Fázový diagram je zde tvořen třemi křivkami:
Křivka tání (označena číslem 1) spojuje stavy, ve kterých je pevná látka v rovnováze se svojí kapalnou fází; odděluje tedy v diagramu pevné a kapalné skupenství.
Křivka syté páry (2) spojuje stavy, ve kterých je kapalina v rovnováze se svojí sytou párou; odděluje tedy kapalné a plynné skupenství.
Sublimační křivka (3) spojuje stavy, ve kterých je pevná látka v rovnováze se svojí sytou párou; odděluje tedy pevné a plynné skupenství.
Na každé křivce platí rovnost chemických potenciálů obou skupenství. Křivky se setkávají v tzv. trojném bodě, kdy látka rovnovážně koexistuje ve všech třech skupenstvích.
Obr. 1 byl přejat z Wikipedie, upraven a přeložen do češtiny.
Poznámka: Fázový diagram může být obecně vícedimenzionální, resp. ve dvou dimenzích mohou na osách vystupovat jiné stavové veličiny než tlak a teplota (typicky termodynamické potenciály).
Teorie: Kritický stav látky
Jak je patrné z obr. 1, křivka syté páry je ukončena v tzv. kritickém bodě, který je charakterizován kritickým tlakem pk a kritickou teplotou Tk. Tabulka 1 udává tyto hodnoty pro některé vybrané látky; kromě tlaku a teploty je uvedena také kritická hustota ρk.
Tabulka 1: Kritické stavové veličiny vybraných látek
látka \(p_\mathrm{k}\,/\,\mathrm{MPa}\) \(T_\mathrm{k}\,/\,\mathrm{K}\) \(\rho_{\mathrm{k}}\,/\,\mathrm{kg{\cdot}m^{-3}}\) voda 22,1 647,1 322 ethanol 6,1 513,9 276 oxid uhličitý 7,4 304,1 469 ethan 4,9 305,3 203 dusík 3,4 126,2 313 helium 0,2 5,2 70 V kritickém bodě (kritickém stavu) se stírá rozdíl mezi kapalným a plynným skupenstvím – mizí okem viditelné rozhraní, zanikají rozdíly v hustotě, mizí povrchové napětí a měrné skupenské teplo vypařování je nulové (viz Odpařování vody a lihu (s termovizní kamerou), Více o měrném skupenském teple vypařování).
Při teplotách a tlacích převyšujících kritické hodnoty pk a Tk se látka nachází ve fázi, kterou nelze nazývat ani plynnou, ani kapalnou; používá se označení superkritická tekutina (obr. 1), někdy také superkritická kapalina.
Pomůcky
Postup
Připravíme si do kádinky vodu o teplotě 45 °C až 50 °C, která bude sloužit jako vodní lázeň pro tyčinku s oxidem uhličitým.
Zapneme diaprojektor a umístíme před jeho lampu tyčinku tak, aby se nám na plátno/stínítko promítla hladina kapalného oxidu uhličitého.
Zasuneme dolní konec tyčinky do vodní lázně a zahříváme v ní tyčinku do té chvíle, dokud nezmizí rozhraní mezi kapalným a plynným skupenstvím.
Jakmile rozhraní zmizí, vyjmeme tyčinku z vodní lázně a necháme ji na vzduchu volně chladnout, dokud se v ní neobnoví výchozí stav.
Vzorový výsledek
Úspěšné provedení experimentu ukazuje video níže. V dolní části tyčinky je na začátku experimentu kapalný oxid uhličitý, nad ním jeho sytá pára.
První část videa zachycuje přechod kapalného oxidu uhličitého a jeho syté přes kritický stav (kdy mizí rozhraní mezi kapalným a plynným skupenstvím) do fáze superkritické tekutiny.
Druhá část videa sleduje děj opačný, tj. přechod superkritického oxidu uhličitého přes kritický stav zpět do výchozího fázového uspořádání.
Technické poznámky
POZOR! Protože oxid uhličitý je ve skleněné trubičce uchováván pod tlakem vyšším než 7 MPa, je nezbytné provádět celý experiment s extrémní opatrností a nevystavovat tyčinku žádným otřesům, natož pak riziku pádu apod.
Metodické poznámky
Na výše uvedeném videu je při přechodu oxidu uhličitého ze superkritického do „běžného“ stavu patrné výrazné potemnění uvnitř tyčinky. Je vhodné studenty upozornit, že tento efekt je způsoben promítáním diaprojektorem; ve skutečnosti v tyčince vzniká bílá mlha, která při promítání brání průchodu světla a jeví se tak tmavě.
Z grafu na obr. 1 můžeme se studenty vyčíst, že plyn o nadkritické teplotě nelze žádným (libovolně velkým) stlačením zkapalnit; může však dojít k jeho desublimaci.
Můžeme studenty upozornit, že přechod přes kritický stav nemusíme pozorovat pouze na rozhraní kapaliny a její syté páry, ale také na rozhraní dvou nemísitelných kapalin.
Kritický stav můžeme popsat také matematicky jako inflexní bod na tzv. kritické izotermě v pV-diagramu, tj. podmínkou:
\[\left(\frac{\partial p}{\partial V}\right)_T\,=\,\left(\frac{\partial^2 p}{\partial V^2}\right)_T\,=\,0\]Dosadíme-li do těchto podmínek závislost \(p\,=\,p(V)\) pro reálný (van der Waalsův) plyn, můžeme dostat odhad kritické teploty a tlaku pro danou látku. Bohužel, van der Waalsův model není určen pro popis látky v okolí kritického stavu, proto jsou získané výsledky velmi nepřesné.
Alternativní znázornění (video)
Další kvalitně natočenou videosekvenci zachycující kritický stav oxidu uhličitého lze najít např. zde.
Více o superkritických tekutinách
Pro studenty může být zajímavé, že se superkritickými tekutinami se můžeme setkat například v podobě atmosféry některých planet. Atmosféra Venuše je tvořena zejména oxidem uhličitým (96,5 %) a dusíkem (3,5 %). Protože při povrchu Venuše vládne atmosférický tlak vyšší než 9 MPa a střední teplota přes 700 K, je při pohledu do tabulky 1 jasné, že obě tyto látky zde existují právě ve formě superkritických tekutin.
Vlastnosti a využití superkritických tekutin shrnuje například diplomová práce Marcely Liškové z PřF MU.
Superkritické vodě se pak detailně věnuje článek Vlastnosti a použití superkritické vody, publikovaný v r. 2013 v Chemických listech.